血液样本是ELISA中最常见的生物液体样本,其中在检测上有全血、血清、血浆、血凝块和血细胞的区分,ELISA常用血清和血浆
血液是一种流体组织,在心血管系统内循环流动,起着运输物质的作用。血液组织是结缔组织的一种,由血浆和血细胞组成。
血浆内含血浆蛋白(白蛋白、球蛋白、纤维蛋白原)、脂蛋白等各种营养成分以及无机盐、氧、激素、酶、抗体和细胞代谢产物等。血细胞有红细胞、白细胞和血小板。
哺乳类的血液具有凝血机制,血管破裂时,血小板会结集,堵塞血管破口,此时血浆中原本可水溶的血纤维蛋白等凝固成为血块,剩余的透明液体就叫做血清。
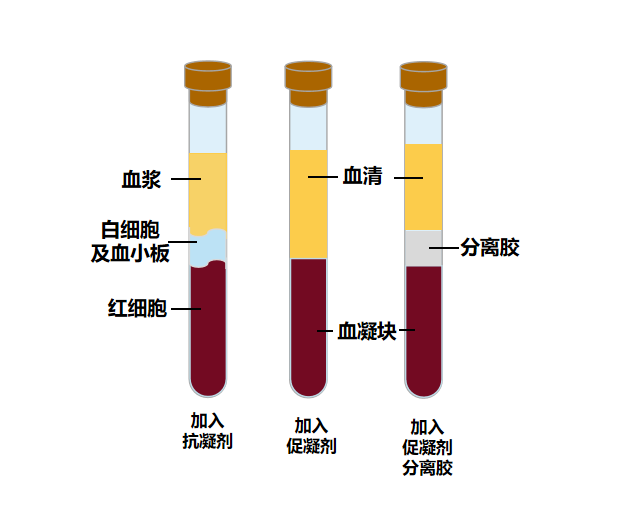
从采集样本来说,直接抽取采集的为全血,呈红色。静置后1-2h,会发生凝血反应,形成血清(呈黄色透明液体)和血凝块。在收集管中提前加入抗凝剂,混匀后离心,即可分离出血浆。


血清和血浆样本的主要区别在于血浆中抗凝剂和凝血因子的影响。
多数指标中血浆样本可以替代血清,前提是该指标不受抗凝剂成分和凝血因子的影响(如抗体类项目),但生化指标则不可用EDTA抗凝分离血浆,因为EDTA-K2此种抗凝剂不仅可以络合重金属Mg2+,也会致使K+的含量上升,故生化指标的最佳样本是血清。一般全血能收集到30-50%左右的血清/血浆。
血红蛋白类指标需采用溶血剂破碎血细胞后来进行测定,凝血因子类指标需使用血浆,其他部分指标血清血浆中有较大差异,血清血浆样本类型的选取,建议多参考国内外文献,选择合适的样本类型。
| 常见的采血管
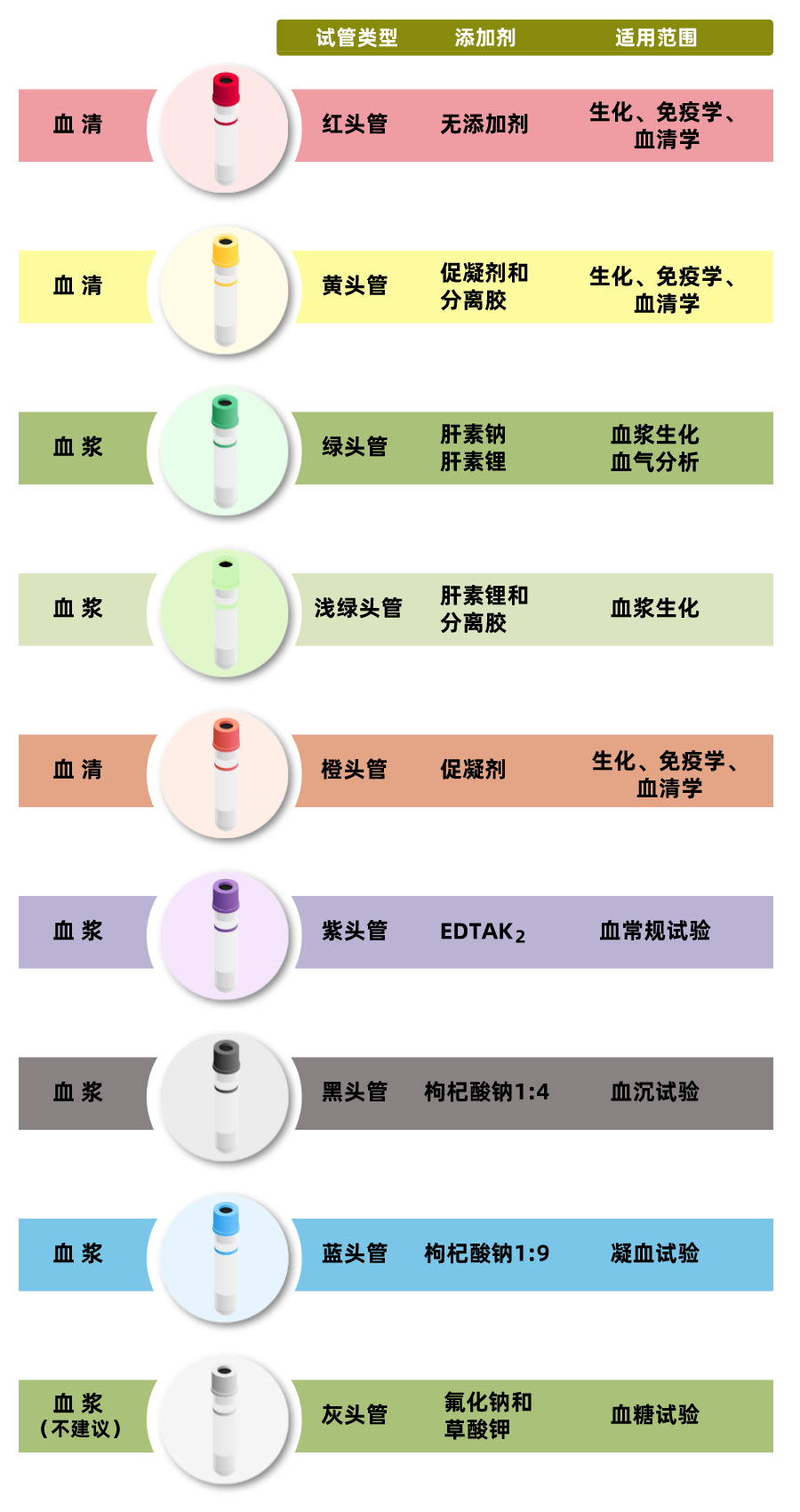
真空采血管是采血材料中装血液标本的试管,管内有真空压力,在护士采血操作穿刺达到血管后,把穿刺针另一端插入试管,血管内的血液通过管内真空压力自然把血管内的血液往试管内排出,当达到一定采血量后管内的压力自然减小,不会继续出血。需要护士采血操作时使用,如果是事先把试管盖打开,管内的压力就会改变,不是成负压状态就没有真空压力的作用。
除红头管无添加外,其他采血管中均含有添加剂,需采血后颠倒混匀5/8次。血清管凝集后离心分离出血清,血浆管需要混匀后离心分离出血浆。用于ELISA测试的样本建议于 4℃保存24h 内完成离心分离,避免长时间存放/冻融引起血细胞破碎,发生溶血反应影响ELISA实验。

动物采血管少量采血,建议采用无菌无毒素的离心管收集,自然凝集后离心分离血清;或抗凝离心管(肝素/EDTA分离血浆),轻轻颠倒混匀后离心分离血浆。

| 剪尾取血法
将清醒鼠装入深颜色的布袋中,将鼠身裹紧,露出尾巴,用酒精涂擦或用温水浸泡使血管扩张,剪断尾尖后,尾静脉血即可流出,用手轻轻地从尾根部向尾尖挤捏,可取到一定量的血液。取血后,用棉球压迫止血。也可采用交替切割尾静脉方法取血。用一锋利刀片在尾尖部切破一段尾静脉,静脉血即可流出,每次可取0.3~0.5 ml,供一般血常规实验。三根尾静脉可替换切割,由尾尖向根部切割。由于鼠血易凝,需要全血时,应事先将抗凝剂置于采血管中,如用血细胞混悬液,则立即与生理盐水混合。
| 眼球后静脉丛取血法
左手持鼠,拇指与中指抓住颈部皮肤,食指按压头部向下,阻滞静脉回流,使眼球后静脉丛充血,眼球外突。右手持1%肝素溶液浸泡过的自制吸血器,从内呲部刺入,沿内下眼眶壁,向眼球后推进4~5 mm,旋转吸血针头,切开静脉丛,血液自动进入吸血针筒,轻轻抽吸血管(防止负压压迫静脉丛使抽血更困难),拔出吸血针,放松手压力,出血可自然停止。也可用特制的玻璃取血管(管长7~10 cm,前端拉成毛细管,内径0.1~1.5 mm,长为1 cm,后端管径为0.6 cm)。必要时可在同一穿刺孔重复取血。此法也适用豚鼠和家兔。
| 眼眶取血法
左手持鼠,拇指与食指捏紧头颈部皮肤,使鼠眼球突出,右手持弯镊或止血钳,钳夹一侧眼球部,将眼球摘出,鼠倒置,头部向下,此时眼眶很快流血,将血滴入预先加有抗凝剂的玻璃管内,直至流血停止。此法由于取血过程中动物未死,心脏不断跳动,一般可取鼠体重4%~5%的血液量,是一种较好的取血方法,但只适用一次性取血。
| 心脏取血
动物仰卧固定于鼠板上,用剪刀将心前区毛剪去,用碘酒、酒精消毒此处皮肤,在左侧第3~4肋间用左手食指摸到心搏,右手持连有4~5号针头的注射器,选择心搏最强处穿刺,当针头正确刺入心脏时,鼠血由于心脏跳动的力量,血自然进入注射器。
| 断头取血
实验者带上棉手套,用左手抓紧鼠颈部位,右手持剪刀,从鼠颈部剪掉鼠头迅速将鼠颈端向下,对准备有抗凝剂的试管,收集从颈部流出的血液,小鼠可取血0.8~1.2 ml,大鼠可取血5~10 ml。
| 颈动静脉、股动静脉取血
麻醉动物背位固定,一侧颈部或腹股沟部去毛,切开皮肤,分离出静脉或动脉,注射针沿动静脉走向刺入血管。20 g小鼠可抽血0.6 ml,300 g大鼠可抽血8 ml。也可把颈静脉或颈动脉用镊子挑起剪断,用试管取血或注射器抽血,股静脉连续多次取血时,穿刺部位应尽量靠近股静脉远心端。
| ELISA操作前必读 / 下载
